|
|
"빠르면 연내, 늦어도 1년 이내에 호주에서 '카티스템' 판매가 가능할 겁니다."
양윤선(51·사진) 메디포스트(078160) 대표는 7일 서울 서초동 본사에서 진행한 서울경제신문과의 인터뷰에서 "호주에서 해외시장 진출의 첫 테이프를 끊을 가능성이 높다"며 이렇게 말했다.
카티스템은 토종 무릎연골재생 줄기세포 치료제로 이미 호주·뉴질랜드·인도·홍콩·마카오 등에서 판권계약이 체결돼 있다. 이중 호주는 한국에서 실시한 임상시험 결과를 바탕으로 추가 임상 없이 곧바로 품목허가를 받을 수 있어 가장 빨리 판매허가가 날 것으로 기대된다.
양 대표는 "호주 시장 진입에 성공하면 뉴질랜드나 캐나다·싱가포르에서도 큰 어려움 없이 품목허가를 받을 수 있어 (호주 시장 진출에) 공을 들이고 있다"고 소개했다.
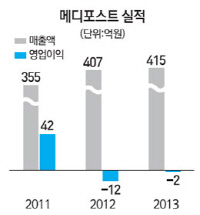
지난 2012년부터 국내에서 판매를 시작한 카티스템의 매출도 꾸준히 상승세를 타고 있다. 출시 초기 월 30건에 그쳤던 시술 건수가 올 들어 월평균 70건으로 증가했다. 지난해 20억원 수준이었던 카티스템 판매 매출도 올해는 40%가량 늘어날 것이라는 게 회사 측 전망이다.
양 대표는 "국내에서 인공관절 수술을 받는 환자 숫자가 연간 7만~8만명에 달한다"며 "머지않아 줄기세포 치료제에 대한 신뢰가 쌓이면 이 중 10~20%는 카티스템 시술을 채택할 것으로 확신한다"고 강조했다.
카티스템의 승부처는 단연 세계최대 제약시장인 미국이다. "미국 시장 진출은 재무적 파트너 확보가 선결과제"라고 말하는 양 대표는 현재 미국 현지에서 다수의 투자자들과 협상을 진행 중이다. 그는 "미국에서 카티스템의 1상과 2a상은 자체적으로 진행하고 있지만 3상부터는 임상 비용부담이 급격히 증가한다"며 "다국적 제약사로부터 임상비를 지원받고 카티스템의 판권을 넘기는 방식으로 미국 현지에서 재무적 파트너 유치를 추진하고 있다"고 말했다.
현재 임상 2상이 진행 중인 미숙아 발달성 만성 폐질환 예방 치료제인 '뉴모스템'의 시판 일정은 2017년으로 예상하고 있다. 뉴모스템의 경우 최근 미국 식품의약국(FDA)에서 희귀의약품에 지정될 정도로 차별성을 인정받고 있다.
최근 1·2a상 임상시험 투여를 시작한 알츠하이머성 치매 치료제인 '뉴로스템'의 경우 2019년에는 출시가 가능할 것으로 보인다. 다만 뉴로스템의 출시 시기는 정부의 규제 완화가 수반된다면 출시 시기가 앞당겨질 가능성도 존재한다.
양 대표는 "뇌 질환의 경우 흔한 질병이기도 하지만 치료가 어려운 난치병"이라며 "성체줄기세포 치료제에 대한 안전성은 이미 검증이 된 만큼 뇌 질환에 대해서는 임상 2상 이후 곧바로 환자들이 치료를 받을 수 있도록 시판을 허용해줘야 한다"고 소신을 밝혔다.
보건복지부는 최근 대체치료법이 없는 희귀질환 9가지를 선정, 신의료기술평가 통과 이전에도 줄기세포 치료가 가능하도록 법안을 개정했다. 하지만 사실상 치료가 어려운 뇌 질환과 관련한 줄기세포 치료제는 희귀질환에서 배제됐다.
줄기세포 치료제 포트폴리오 구축 단계에서 그동안 회사의 캐시카우 역할을 하는 것이 제대혈 보관사업이다. 양 대표는 올해 새로운 매출 동력을 추가할 계획이다. 지난해 제대혈 줄기세포 배양액을 원료로 자체 개발한 화장품 브랜드 '셀로니아'가 그것. 양 대표는 "올해 유통망을 확보해 셀로니아를 본격적으로 판매할 계획"이라며 "홈쇼핑이나 네트워크 판매 채널 등 다양한 유통망과 논의를 진행하고 있다"고 전했다.