|
|
메디포스트가 줄기세포 치료제 양산 체제를 구축, 글로벌 시장 공략에 박차를 가할 방침이다.
메디포스트는 5일 서울 구로구에 있는 GMP(우수의약품제조관리기준) 생산시설(공장)을 기존 1,540㎡(466평)에서 총 3,256㎡(985평) 규모로 기존 대비 2배 이상 증설, 연골 재생 치료제인 카티스템 대량 생산에 돌입한다고 밝혔다. 이날 증설 개소식에 참석한 양윤선 대표는 “지금까지 첨단기술 개발에 집중했다면 대량생산 체제로 전환한 것으로 해석할 수 있다”며 “카티스템 투여가 늘어나는 상황에서 생산시설이 증설됨에 따라 수출할 때 국내에서 생산해 내보내는 것에 대한 대비가 가능해졌다”고 설명했다. 그는 또 “특히 생산성을 높이고 자동화 단계로 업그레이드되면서 이익도 늘어날 것으로 기대한다”고 강조했다.
이번 증설로 메디포스트는 줄기세포 첨단 배양 공정법을 통해 하나의 간엽줄기세포에서 8,000 바이알을 생산, 효율성을 높이게 됐다. 이전에는 500바이알 가량을 만들었다. 이는 하나의 제대혈에서 훨씬 더 많은 치료제를 만들 수 있다는 의미다.
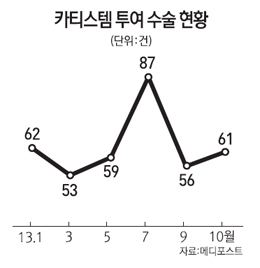
아울러 메디포스트는 시설 점검 등의 이유로 생산이 중단되는 경우를 크게 줄일 전망이다. 회사 관계자는 “8월에 GMP 시설 점검으로 4일만 투여 수술이 진행됐는데 내년부터는 증설 전후 시설이 번갈아 가며 점검을 받게 되므로 가동하지 않는 기간이 없게 된다”고 설명했다.
세계 최초의 동종(타가) 줄기세포 치료제인 카티스템 투여는 지난해 월 평균 23건에서 올해 10월에는 58건으로 증가했다. 누적으로는 782건에 달한다. 투여 병원도 올해 들어 30여 곳이 증가해 삼성서울병원 등 총 130여 곳으로 확대됐다.
이번 증설을 계기로 메디포스트는 해외 시장 공략에 박차를 가할 계획이다. 카티스템은 홍콩ㆍ마카오, 호주ㆍ뉴질랜드와 판권 계약을 맺고 있으며 미국에서 임상 1/2a상 피험자 5/12를 진행 중이다. 양 대표는 “홍콩 등 아시아 국가의 경우 서울GMP에서 생산해 완제품 형태로 공급할 예정이어서 안정적으로 해외에 진출할 수 있다”고 강조했다.
앞서 이 회사는 최근 캐나다 기업과도 MOU를 체결한 상태다. 현지 판매가 원활하도록 넓은 토지를 고려한 카티스템의 업그레이드 형을 개발한다는 게 골자다.
이와는 별도로 메디포스트가 개발 중인 ‘뉴로스템-AD(알츠하이머성 치매 치료제)’와 ‘뉴모스템(발달성 폐질환 치료제)’의 임상시험도 순조롭게 진행되고 있다. 회사 관계자는 “이번 증설은 이들 신규 줄기세포 치료제 파이프라인의 상용화와 대량 생산에 대비하는 측면도 크다”고 분석했다.
뉴로스템-AD는 지난 9월 식품의약품안전처로부터 임상 1/2a상 계획 승인을 받고 현재 삼성서울병원 IRB 심사 중이며 임상 환자 문의가 쇄도하는 것으로 알려졌다. 뉴모스템은 삼성서울병원과 서울아산병원에서 임상 2상 중이며 30% 이상 진행됐다. 양 대표는 “난치병은 새로운 약에 대한 니즈가 강해 뉴로스템과 뉴모스템 모두 계획보다 속도가 빠르게 진행되고 있다”고 말했다.