|
|
|
지난달 30일 서울 여의도에서 열린 셀트리온 기업설명회(IR)장에 몰린 투자자들의 얼굴에는 한결같이 근심이 가득했다. 좋은 실적에도 불구하고 공매도 세력의 공격 때문에 올 들어 셀트리온의 주가가 부진한 상황이기 때문이다. 하지만 이 같은 어두운 분위기는 서정진(사진) 셀트리온 회장이 등장하면서 사라지기 시작했다. 서 회장이 "내년부터 매년 1건 이상의 신약 실험을 실시하겠다"고 밝히는 등 앞으로 사업 계획을 구체적으로 설명하자 참가자들은 고개를 끄덕이거나 손뼉을 치는 등 앞으로 셀트리온이 만들 청사진에 공감을 나타냈다. 그동안 투자자들 마음 속에서 차츰 커져가던 투자 불안감이 서 회장의 적극적인 IR에 눈 녹듯 사그라진 것이다. 2년 이상 셀트리온 주식에 투자하고 있다고 밝힌 한 투자자는 "그동안 궁금했던 점을 회사 대표가 직접 나서 밝혀주니 한층 믿음이 간다"며 "계속 믿고 투자한 보람이 있다"고 말하기도 했다.
셀트리온이 공매도의 그림자를 걷어내고 공격적인 신약 개발에 나서며 글로벌 대표 바이오시밀러 제조기업으로의 꿈을 키워가고 있다. 특히 최근에는 상용화에 처음 성공한 신약이 유럽 등 해외시장에 본격 진출하면서 내년 실적에 대한 기대감을 키우고 있다.
이 같은 계획의 선봉에는 국내에서 판매가 시작된 자가면역질환 치료제 '램시마'가 나섰다. 램시마는 류머티즘ㆍ관절염 등 자가면역질환 치료에 사용되는 항체의약품 바이오시밀러다. 지난 7월 식품의약품안전청(KFDA)에서 판매를 허가한 동등생물의약품으로 경쟁 항체의약품에 비해 부작용은 작고 가격은 35~40% 저렴한 게 특징이다.
셀트리온의 한 관계자는 "이미 다수의 종합병원 약물위원회를 통과해 처방이 시작됐다"며 "내년부터 유럽에서도 램시마 판매를 시작할 계획"이라고 설명했다. 이어 "유럽의약품청(EMA)의 제품 허가가 예상되는 내년 상반기에는 램시마가 판매되는 국가가 50~60개국으로 늘어날 것으로 전망된다"고 덧붙였다.
최근에는 비호지킨스 림프종 치료제인 리툭산 바이오시밀러(CT-P10)와 종합독감항체 치료제 'CT-P27'을 개발하고 있다. CT-P10의 경우 내년 중 임상 1상을 마치고 3상에 돌입할 계획이고 CT-P27은 현재 진행하는 비 임상 시험 결과에 따라 내년 중 환자 대상 임상을 본격 실시한다. 이 외에 유방암 치료제인 허셉틴 바이오시밀러(CT-P06)도 내년 중 판매 승인 과정을 거쳐 본격 시판에 나선다는 방침이다.
셀트리온 관계자는 "램시마에 이어 내년에는 CT-P06의 본격 상용화가 예상된다"며 "CT-P27의 경우 미국 질병통제센터(CDC)와 세브란스병원ㆍ서울대학병원 등 국내외 전문기관과 협력해 개발 중"이라고 밝혔다.
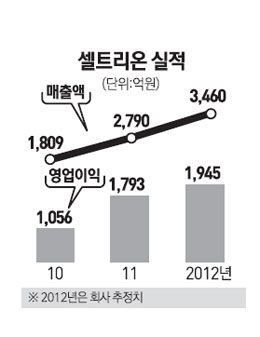
서 회장은 "현재 7개 바이오시밀러 후보군과 5개 자체 신약 후보군에 대한 연구개발(R&D)을 진행하고 있다"며 "램시마 상용화에 이어 허셉틴 바이오시밀러 판매 등 영향으로 내년 매출액과 영업이익은 각각 5,104억원과 2,690억원에 이를 것"이라고 말했다.
증권업계에서도 셀트리온에 긍정적 시선을 보내고 있다. 램시마 본격 상용화에 따라 매출 확대가 예상되고 상용화되는 신약도 갈수록 늘어날 것으로 기대되기 때문이다.
김현태 신영증권 연구원은 "셀트리온헬스케어 쪽에서 발생하는 바이오시밀러 상업 배치 매출 증가에 따라 올 4ㆍ4분기 실적 개선이 가능할 것으로 전망된다"며 "올해 4ㆍ4분기 매출액과 영업이익은 지난해 같은 기간보다 30%, 11.5% 늘어난 1,005억원, 584억원을 기록할 것"으로 추정했다.
김 연구원은 이어 "앞으로 램시마 승인 국가가 확대되고 또 내년에는 허셉틴 바이오시밀러의 국내 허가가 점쳐지고 있다"며 "올 4ㆍ4분기는 물론 내년에도 실적 향상이 기대되고 있다"고 덧붙였다.