‘앱클론(174900)’은 혈액암 CAR-T 치료제(AT101) 임상후보물질 도출에 성공했다고 6일 발표했다.
앱클론의 AT101은 B세포 유래 백혈병과 림프종 치료를 목적으로 개발되고 있는 신규 CAR-T 치료제로, 연내 임상 진입을 계획하고 있으며 이를 위해 생산 설비 도입 및 GMP 생산 라인 구축, 주요 병원과의 계약 등 생산부터 병원 치료 전반에 대한 사업화를 준비 중이다.
노바티스의 CAR-T 치료제 ‘킴리아’의 경우 신속심사를 통해 IND 이후 3년 이내에 승인된 바 있어 앱클론의 AT101도 임상 진입 후 신속한 승인이 기대된다.
CAR-T 치료제의 임상 결과들은 획기적이라는 평가를 받고 있다. 노바티스의 킴리아의 경우, 난치성·재발 급성 림프모구 백혈병 소아와 젊은 성인 환자를 대상으로 한 임상시험에서 3개월만에 완전관해율 83%라는 유례없는 효과를 보였다.
Coherent market insights에 따르면 글로벌 CAR-T 치료제 시장은 2017년 7,200만달러에서 앞으로 11년간 연 평균 53.9% 성장해 2028년에는 83억달러 규모로 확대될 전망이다.
CAR-T 치료제 임상 1상 파이프라인을 보유 중이던 Kite Pharma와 Juno Therapeutics는 각각 Gilead Science(118억달러)와 Celgene(80억달러)에 거액의 인수대금으로 합병되기도 하였다.
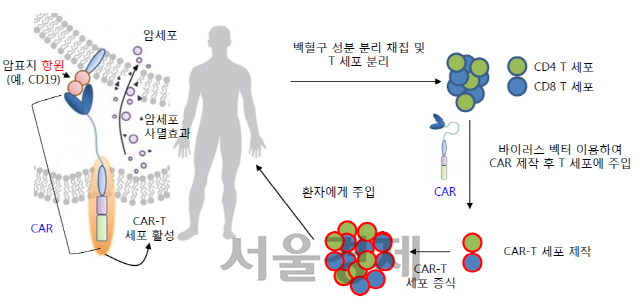
CAR-T 치료제는 암세포에 특이적으로 반응하는 키메라 항원 수용체(Chimeric Antigen Receptor, 이하 CAR)를 장착시킨 T 세포(CAR-T)를 제조해 암 환자에게 주입함으로써 항암 면역반응을 일으켜 암세포를 사멸시키는 새로운 면역항암제이다. CAR-T 기술은 환자 본인의 세포들을 이용하기 때문에 환자의 거부반응 없이 선택적으로 암세포를 사멸할 수 있다는 이점이 있다. 또한, 살아있는 세포를 사용하기 때문에 생체 내에서 장시간 증식이 가능하기 때문에 1회 투여로 치료가 가능하며 재발률 역시 낮출 수 있다.
앱클론의 AT101은 노바티스의 킴리아, 길리어드의 예스카타와 동일한 CD19 질환 단백질을 표적으로 하지만 NEST 플랫폼을 통해 개발한 다른 부위에 결합하는 새로운 항체를 이용해 기존 CAR-T 치료제 대비 면역원성을 제거했다는 차별점이 있다.
또한 앱클론은 기존 CAR-T 치료제가 가진 단점인 독성 문제와 질환 확장성 문제 등을 극복할 수 있는 스위처블(Switchable) CAR-T 원천기술을 확보하고 서울대 의과대학과 난소암 치료를 위한 차세대 CAR-T 제품(AT501)도 개발하고 있다.
이종서 앱클론 대표이사는 “미국과 유럽에선 최근 CAR-T 치료제가 출시되어 많은 혈액암 환자들이 혜택을 보고 있지만, 국내 혈액암 환자들은 아직 그렇지 못하다”며 “CAR-T 치료제가 혁신의약품인 만큼 국가 차원 신약 개발 지원 제도를 활용하여 국내 최초로 AT101을 신속하게 출시할 계획이고, 이번 AT101과 더불어 차세대 스위처블 CAR-T 플랫폼 개발이 가시화 되고 있는 만큼 혈액암뿐만 아니라 고형암으로 확대해 전 세계 환자들이 독성 문제 없이 보다 향상된 효능의 CAR-T 치료제의 혜택을 받을 수 있도록 노력하겠다“고 밝혔다.