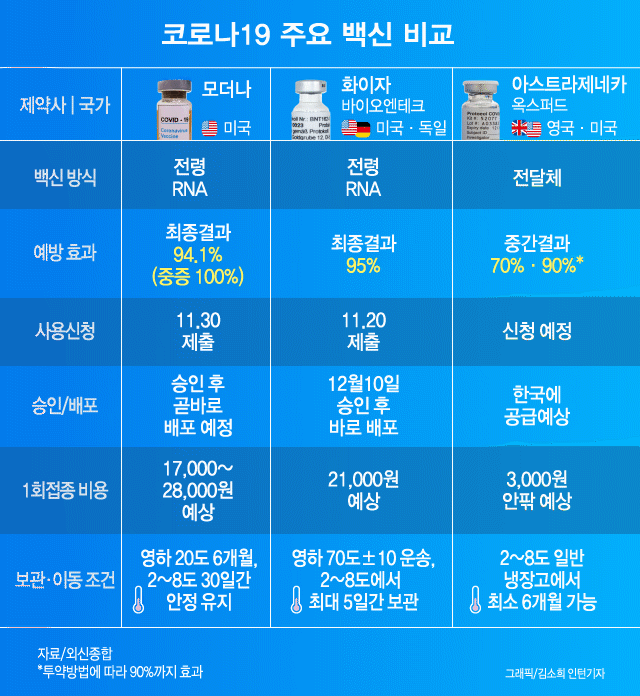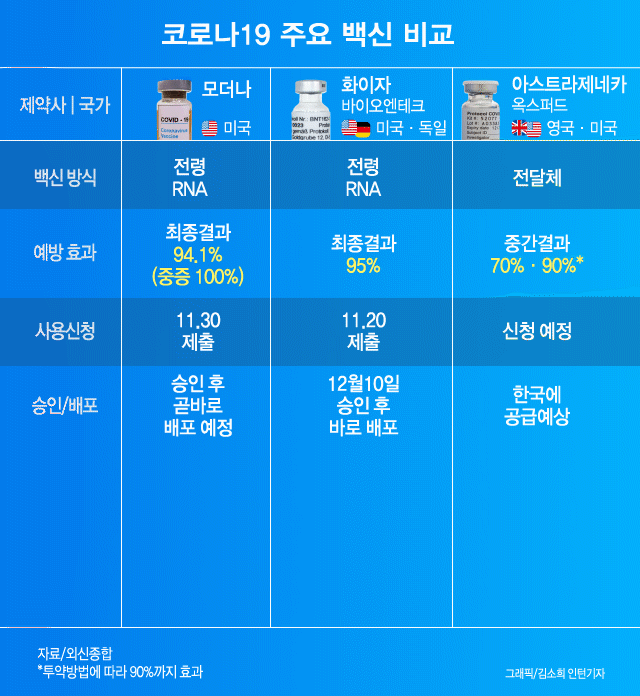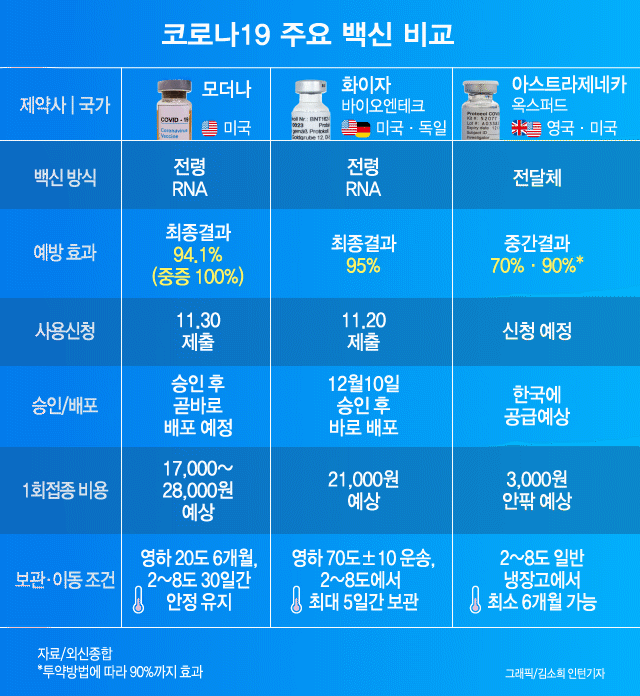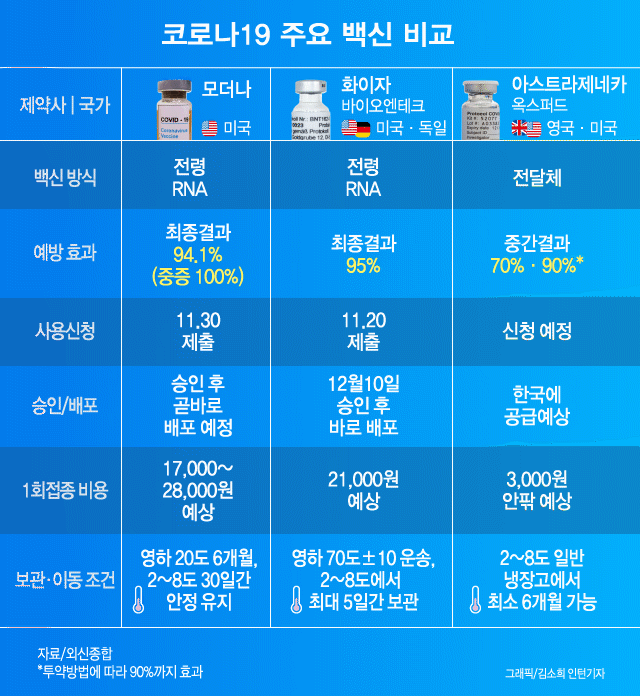
신종 코로나바이러스 감염증(코로나19) 백신 경쟁에서 가장 앞섰다는 기대를 모았던 영국 아스트라제네카와 옥스퍼드의 백신이 미국 보건당국에 정보를 은폐하는 바람에 뒤처지게 됐다고 뉴욕타임스(NYT)가 지난 8일(현지시간) 보도했다.
보도에 따르면 아스트라제네카는 9월 6일 백신 임상 참여자에게서 원인을 알 수 없는 부작용이 발생해 전 세계에서 시험을 중단하기로 했다. 이틀 뒤인 9월8일 아스트라제네카는 미 식품의약국(FDA)과 긴급 승인과 관련해 전화로 회의하면서 이 사실을 말하지 않았다.
FDA는 이 회의가 끝나고서 몇 시간이 지나 중단 사실을 파악했고 아스트라제네카의 불투명성에 크게 실망했다는 것이다. 미 정부는 아스트라제네카가 공언대로 10월 백신을 출시하게 되면 필요량의 60%(약 3억회 접종분)를 이 회사에서 충당할 참이었다. 화이자, 모더나가 개발하는 백신보다 아스트라제네카는 가격과 유통 과정, 비용 면에서 장점이 있어서였다.
이튿날인 9월9일 아스트라제네카의 최고경영자(CEO)는 부작용과 임상 중단에 대한 구체적 정보를 대중에 공개하는 대신 투자사 JP모건이 연 비공개 회의에서 제공하는 방법으로 무마를 시도했다. 당시 상용화에 가장 근접했다고 평가받은 이 회사의 백신 개발과 생산에 10억 달러(약 1조1,000억원)을 투자하기로 한 미국 정부로선 불신이 커질 수밖에 없었다.
이 회사가 임상 시험 중이던 영국, 브라질, 인도의 보건 당국은 한 주 뒤 시험을 재개했지만 미국에선 계속 늦어졌다. 그 바람에 FDA의 백신 승인 기준 3만명이 채워지지도 않았고 1차분 임상 접종자가 두번째 접종을 하지 못하는 일도 생겼다. 미국 정부는 이 일이 난 지 한 달 반 뒤인 10월 하순에서야 국내 임상 시험을 재개하도록 했다. 이달 초 기준으로 이 회사의 미국 내 임상 시험은 절반 정도밖에 진행되지 않았다.
NYT는 “아스트라제네카는 백신과 부작용이 관계없다는 증거를 FDA에 늑장 제출했고 이 때문에 미국 내 임상 시험이 수주간 중단됐다”라며 “그 사이에 경쟁사가 치고 나갔다”라고 지적했다. 9월 뿐 아니라 7월12일에도 영국에서 임상 참가자 1명에게서 신경계 부작용이 발생해 아스트라제네카는 잠시 시험을 중단했으나, 이 사실도 FDA에 알리지 않았다고 NYT는 내부 소식통을 인용해 보도했다. 아스트라제네카는 모든 정보를 FDA에 즉시 제공했다면서 NYT의 보도를 부인했다.
아스트라제네카 백신의 상용화가 경쟁사에 뒤처지는 또 다른 이유는 ‘1과 2분의 1 기적’ 때문이라고 NYT는 짚었다. 이 백신을 전량으로 2회 접종했을 때 효능이 62%였으나 1회때 절반, 2회에 전량을 접종했을 때는 90% 이상의 효능을 발휘했기 때문이다. 아스트라제네카와 옥스퍼드대도 이 이유를 아직 설명하지 못하고 있다. NYT는 제조사의 실수로 우연히 얻게 된 이 효능 차이의 원인을 의학적으로 규명하지 못하면 FDA의 긴급 승인은 늦어질 수밖에 없다고 전망했다.
미 정부의 백신개발을 총괄하는 팀 ‘초고속작전’의 몬세프 슬라위 최고책임자는 “효능이 컸던 절반 분량의 접종자 가운데 55세 이상은 없었다”라며 “전염병에 취약한 그 이상의 연령대에 백신이 효과가 없을 수 있다는 점에서 우려스럽다”고 말했다. 그러면서 “절반 접종이 왜 더 효과가 있는지 명확히 설명하지 못하면 사용 승인이 더 어려울 수 있다”라고 지적했다.
/지웅배 인턴기자 sedation@sedaily.com