대사항암제 ‘KAT’를 개발 중인 뉴지랩파마(214870)에 대해 순조로운 임상 진행에 따라 조기 기술 수출을 포함해 파이프라인의 잠재 가치가 크다는 분석이 나왔다.
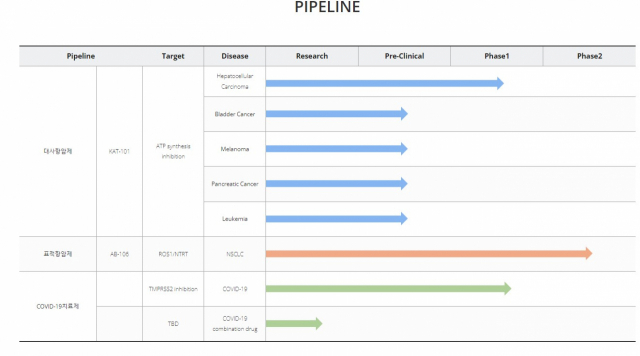
5일 키움증권(039490)은 뉴지랩파마에 대해 4세대 대사 항암제 'KAT-101'의 간암 대상 임상 1·2a상이 미국 식품의약국(FDA)과 한국 식품의약품안전처로부터 승인받아 이번 달 내로 환자모집이 가능할 것으로 예상했다. 나아가 이 임상 데이터를 확인하면서 KAT-101의 적응증 확장성을 고려한다면 더 큰 잠재 가치를 보유하고 있다고 분석했다. 뉴지랩파마는 미국과 한국 자회사 뉴지랩테라퓨틱스에서 항암제를 개발 중인 코스닥 상장사다. 아리제약과 의약품 콜드체인기업 한울티엘을 인수하기도 했다. 목표 주가는 제시되지 않았다.
하혜민 키움증권 연구원은 "KAT-101는 다수의 전임상 동물 실험, 미국암연구학회 췌장암 특별 콘퍼런스(AACR) 췌장암 데이터 등을 통해 안전성이 검증됐고, 간암, 흑색종, 방광염 등 응급임상 치료 사례를 통해 유효성을 검증했다"며 "간암과 흑색종을 대상으로 FDA 희귀의약품(ODD)으로 지정돼 임상 2상 이후 조건부 사용승인을 통해 조기 상업화가 가능한 장점이 있다"고 설명했다. 특히나 "오프라벨 임상으로 채택해 8주마다 임상 데이터를 확인할 수 있어 임상 진행 중에도 유의미한 결과 발표를 통해 조기 라이선스 아웃을 기대해 볼 수 있다"고 강조했다.
시장 가치로는 2017년 8월 FDA로부터 유일하게 승인받은 대사항암제는 아지오스 파마슈티컬스의 'IDHIFA(급성 골수성 백혈병)'으로 2021년 12월 프랑스 제약사 세르비에가 해당 항암사업분야를 20억 달러(약 2조 6000억 원)에 인수한 사례와 비교했다.
여기에 뉴지랩파마의 다른 파이프라인으로 미국 안허트 테라퓨틱스로부터 국내 판권을 도입한 표적항암제 탈레트렉티닙에 대해서도 시장성을 주목했다. 탈레트렉티닙은 현재 국내에서 임상 2상을 진행하고 있으며 지난해 말 첫 투약 후 두 번째 환자까지 등록을 완료했다. 하 연구원은 "지난 6월 치료 경험이 없는 ROS1 폐암 환자까지 암상 대상 확대를 승인받아 국내 약 500억 원 규모의 표준치료제 시장에 대한 가능성까지 확장 됐다"며 "지난 미국임상종양학회(ASCO)에서는 주목할만한 2상 중간 데이터가 발표돼 현재 경쟁 파이프라인 대비 'Best-in-Class' 가능성이 클 것"으로 전망했다.
◇Why 바이오는=‘Why 바이오’ 코너는 증시에서 주목받는 바이오 기업들의 이슈를 전달하는 연재물입니다. 주가나 거래량 등에서 특징을 보인 제약·바이오 기업에 대해 시장이 주목한 이유를 살펴보고, 해당 이슈에 대해 해설하고 전망합니다. 특히 해당 기업 측 의견도 충실히 반영해 중심잡힌 정보를 투자자와 제약·바이오 산업 관계자들에게 전달합니다.