진핵세포는 핵을 비롯한 다양한 기능을 하는 세포소기관을 갖는다. 진핵세포가 세포분열 할 때, 소화작용을 일으키는 세포소기관인 ‘리소좀’의 유전을 조절하는 단백질의 작동원리가 세계 최초로 밝혀져 주목받고 있다.
유니스트(UNIST·울산과학기술원) 생명과학과 이창욱 교수팀은 지스트(GIST·광주과학기술원) 생명과학과 전영수 교수팀과 함께 효모 모델을 활용해 세포분열 시 자가포식에 관여하는 리소좀 단백질인 Vac8이 결합파트너 단백질인 Vac17과 복합체를 형성해 자가포식을 억제하고, 분열된 세포로 리소좀 수송을 조절한다는 사실을 세계 최초로 밝혀냈고 23일 공개했다. 이와 관련된 연구는 향후 세포분열 이상으로 발생하는 암, 만성질환 등 치료연구에 있어서 중요한 초석이 될 것으로 전망된다.
세포분열은 인간을 비롯한 생명체의 생명유지에 있어 필수 불가결한 요소이다. 그래서 이는 많은 세포 내 기전들로 인해 정교하게 조절된다. 특히 완전하고 안전한 세포분열을 위해서는 세포 내 자가포식조절이 매우 중요하다. 자가포식 활동으로 분열하는 세포의 세포소기관 및 구성물질 등이 분해되면 정상적인 딸세포로의 분열이 이루어질 수 없기 때문이다.
리소좀 단백질인 Vac8은 여러 결합파트너와 복합체를 형성해 선택적으로 자가포식을 조절한다고 알려져 있다. 또한, Vac17, Myo2 단백질과 결합해 세포분열 시 리소좀 수송에도 관여한다. Vac8이 Vac17, Myo2와 삼중 구조체를 형성하고, 이렇게 형성된 복합체는 일종의 세포 내 도로의 역할을 하는 액틴 단백질을 통해 모세포에서 딸세포로 리소좀을 수송한다는 것이다.
기존 연구를 통해 Vac8과 Vac17 단백질의 복합체 형성이 리소좀 수송에 중요하다는 사실이 밝혀져 있었으나, Vac8이 어떠한 원리로 세포 내 자가포식을 억제하고, 리소좀 수송 기능을 수행할 수 있는지에 대한 분자 수준의 연구는 밝혀지지 않았다.
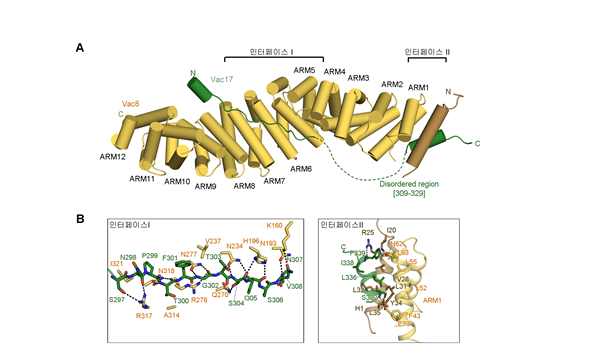
본 연구팀은 X-ray 구조법을 통해 Vac8-Vac17 복합체의 고해상도 구조를 세계 최초로 규명했다. 해당 복합체는 두 개의 결합 인터페이스를 형성한다. 특히 연구팀은 인터페이스 형성에 직접 관여하는 아미노산을 확인했으며, 이 아미노산에 돌연변이가 일어난 Vac8 및 Vac17을 가진 효모에서는 세포 분열시 리소좀이 딸세포로 이동하지 못하는 것을 관찰했다. Vac8 단백질이 리소좀 수송을 조절한다는 것을 직접적으로 입증한 것이다.
또한 이번 연구에서는 Vac8이 특정 결합 파트너와 복합체를 이루었을 때 형성하는 4차 구조가 자가포식과 리소좀 수송을 구별해 조절한다는 사실을 입증해냈다. 연구팀은 이러한 구조적 차이가 Vac8에 포함된 ARM 도메인과 N-말단의 H1 helix에 의한 조절임을 밝혀냈다. Vac8-Vac17의 복합체가 형성되면, Vac17이 Vac8의 H1 helix를 붙잡게 되고, H1 helix가 ARM도메인으로부터 분리되지 않게 만들어 자가포식을 일으키는 복합체(Vac8-Nvj1, Vac8-Atg13) 형성을 억제한다. 이는 세포분열 시, 자가포식이 억제되고 리소좀의 수송이 일어난다는 것을 의미한다.
이창욱 생명과학과 교수는 “이 연구는 세포분열 시 자가포식 활동의 억제와 리소좀 수송이 한가지 단백질에 의해 어떻게 조절될 수 있는지를 보여준 중요한 사례다”며 “세포분열과 관련된 질병인 암 및 여러 종류의 만성질환 등의 연구에 대한 중요한 초석이 될 것이다”고 밝혔다.
이번 연구결과는 미국과학학술원회보(PNAS) 4월 24일자로 게재됐다. 연구 수행은 과학기술정보통신부 한국연구재단 등의 지원을 받아 이뤄졌다.