국내 연구진이 국제 공동연구를 통해 살아있는 세포와 같은 형태와 기능을 가지면서 빛을 사용해 스스로 에너지를 생산하는 인공세포를 만드는 데 성공했다. 아직 생식기능이나 항상성 등에서 한계가 있지만 현재까지 인공적으로 구현된 세포 중 가장 진화한 형태로, 스스로 외부 환경에 적응하고 성장하는 생명체를 인간이 만들어낼 수 있다는 가능성을 보여줬다는 평가다.
과학기술정보통신부는 신관우 서강대 교수와 케빈 파커 하버드대 교수, 안태규 성균관대 교수, 정광환 서강대 교수가 공동연구를 통해 스스로 광합성을 하는 인공세포를 제작하는 데 성공했다고 28일 밝혔다. 연구성과는 국제학술지 ‘네이처 바이오테크놀로지’에 게재됐으며 네이처의 하이라이트 논문으로도 소개됐다.
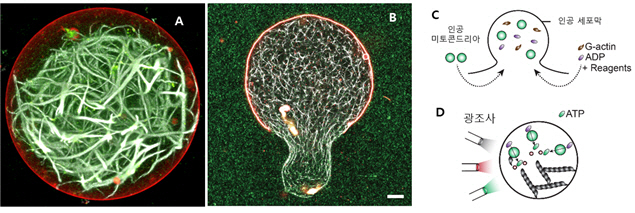
연구팀은 시금치에서 광합성 단백질을, 박테리아에서 광전환 단백질을 뽑아낸 후 빛을 사용해 생체에너지(ATP)를 생산할 수 있는 인공 미토콘드리아를 만들었다. 또 인공 미토콘드리아를 인공세포막에 삽입해 골격단백질을 스스로 합성하며 움직이는 인공세포를 만드는 데 성공했다. 골격단백질은 빛을 사용해 스스로 생체에너지를 생산하고 이를 이용해 세포의 움직임과 형태를 구성하는 기능을 한다.
외부에서 빛을 쪼여주면 인공 미토콘드리아는 세포 내 환경에 따라서 스스로 작동하며 지속적으로 생체에너지를 만든다. 이를 통해 형성된 골격단백질이 주변의 세포막을 움직이도록 해 마치 세포가 외부 환경에 따라 스스로 움직임을 보이는 것과 같이 대사활동을 수행한다.
이번에 개발된 인공세포는 외부환경에 따라 최소 한달까지 지속적으로 대사활동을 하며 광합성을 할 수 있다. 이 기술을 활용하면 세포 내에서 벌어지는 다양한 의학적 부작용이나 대사활동의 비정상적 활동의 원인을 밝혀낼 수 있을 것으로 기대된다. 또 기능이 저하된 세포를 대체할 수 있는 기능성 세포를 제작하거나, 인공적으로 배양된 장기·조직을 구현하는 데도 활용될 수 있다.
신 교수는 “이 인공세포는 인간이 만든 최초의 살아있는 세포와 가장 근접한 구조체”라며 “인간이 반드시 정복해야 할 인공생명체를 구현하기 위해 연구를 더욱 발전시켜 나가겠다”고 말했다.