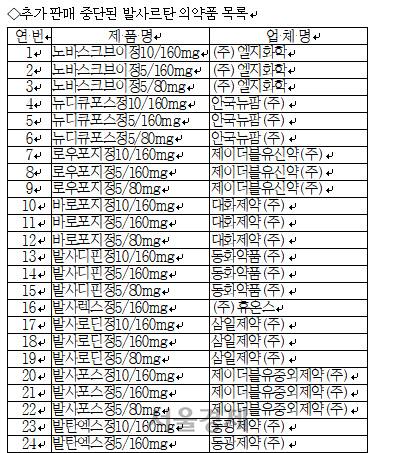
식약처는 앞서 중국 제지앙화하이가 제조한 고혈압 약 ‘발사르탄’의 원료에서 발암물질인 NDMA가 검출돼 국내 수입·제조되는 모든 품목에 대해 수거·검사를 진행한 결과 대봉엘에스가 제조·판매하는 일부 제품에서 잠정 관리 기준을 초과한 NDMA가 검출됐다고 밝혔다. 대봉엘에스의 제품은 중국 주하이룬두의 원료를 수입·정제해 발사르탄 원료를 제조하는 회사다. 식약처 조사에 따르면 현재 대봉엘에스가 공급한 원료를 사용해 제조된 완제의약품은 22개사 59개 품목에 이르며 생산량은 전체 발사르탄 완제의약품의 10.7%에 달한다. 식약처는 제품들에 대해 잠정 판매 중지 및 처방 제한 조치를 내렸다.
식약처는 제지앙화하이사의 고혈압 약 원료에서 발암물질이 발견된 후 유사한 제조공정으로 제조된 품목들로 조사·검사를 확대실시한 바 있다. 이 조사에서 별다른 문제를 발견하지 못하자 화하이와 제조 공정이 달라도 추가 확인이 필요한 발사르탄에 대해 자료 검토 및 수거 검사를 실시했다. 그 결과 주하이룬두의 원료를 수입, 재가공한 대봉엘에스의 발사르탄에서 문제가 발견돼 조치를 취했다는 설명이다. 대봉엘에스가 공급한 발사르탄의 국내 비중은 약 3.5% 수준이다.
식약처는 향후 중국 화하이가 제조한 발사르탄 외 다른 원료의약품에 대해서도 조사를 진행할 방침이다.
한편 식약처는 앞으로 발사르탄 내 불순물인 ‘NDMA’ 관리를 강화하기 위해 관련 규정 개정을 통해 기준을 0.3ppm 이하로 설정해 관리할 예정이라고 밝혔다. 이 기준은 국제의약품규제조화위원회가 권고하고 있는 가이드라인과 국내외 자료 및 전문가 자문 등을 검토해 설정됐다. 이번에 설정된 기준은 향후 발사르탄 및 발사르탄이 함유된 모든 완제의약품에 적용되며 기준 초과시 해당 제품은 회수 조치될 방침이다.
문제가 된 59개 제품을 처방받은 환자는 진료받는 병원을 방문해 다른 의약품으로 재처방 및 재조제를 받을 수 있다. 처방은 기존 처방 중 남아있는 기간에 대해서만 가능하다. 의료기관을 방문할 수 없어 약국에 가더라도 의약품을 교환할 수 있다. 재처방과 재조제에 환자 부담은 없다.