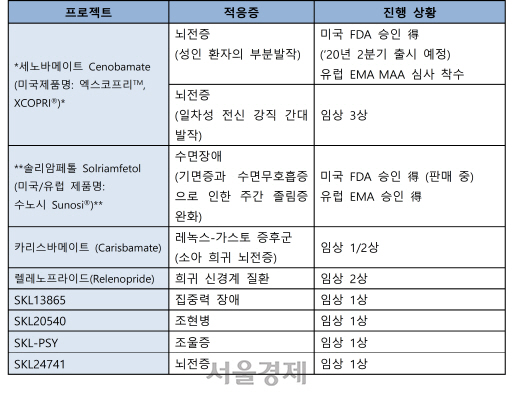
SK바이오팜이 유럽의약청(EMA)에 제출한 뇌전증 신약 ‘세노바메이트’의 신약 판매 허가 신청서(Marketing Authorization Application)가 서류 요건을 통과해 본격적인 심사에 돌입했다.
27일 SK바이오팜에 따르면 세노바메이트는 독자 개발 신약으로 작년 11월 미국 FDA(식품의약국)에서 판매 승인을 받았다. 미국 제품명은 엑스코프리다.
이후 유럽 지역 상업화를 위해 작년 2월 유럽 파트너사 아벨 테라퓨틱스에 기술 수출했다. 아벨은 세노바메이트의 글로벌 임상 시험 데이터를 활용해 유럽의약품청(EMA)에 성인 대상 부분 발작 치료의 부가 요법으로 신약 판매 허가 신청서를 제출했다. EMA의 자료 검토 이후 산하기관인 약물사용자문위원회(Committee for Medicinal Products for Human Use)에서 현재 정식 검토에 착수한 상태다.
조정우 SK바이오팜 사장은 “이번 유럽 신약판매허가 신청서 접수는 세노바메이트가 미국에 이어 유럽 진출도 본격화하게 된 것”이라며 “세노바메이트가 전세계 뇌전증 환자들의 새로운 치료 옵션으로 자리 잡을 수 있도록 노력하겠다”고 말했다.
한편, SK바이오팜은 미국에서 세노바메이트를 올 2분기(4~6월) 내 출시할 계획이다. 마케팅과 판매는 미국 법인 SK라이프사이언스(SK Life Science)가 맡는다.