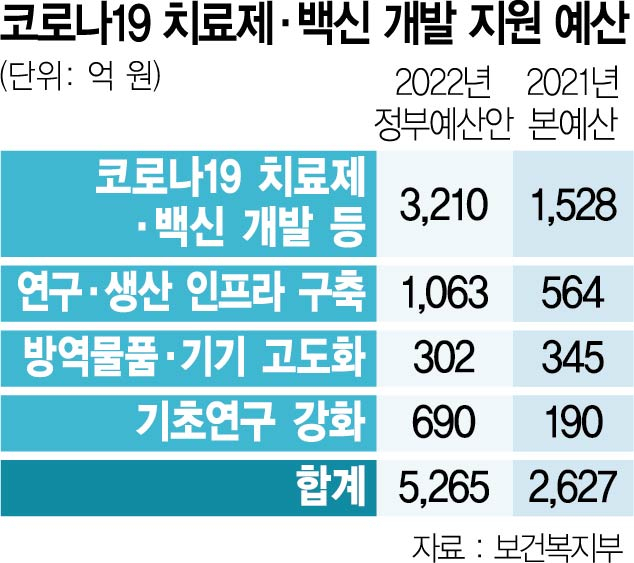
정부가 코로나19 치료제와 백신 개발을 위해 내년 총 5,265억 원을 투입하겠다는 계획을 공개했다. 올해(2,627억 원)보다 두 배 이상 증가한 규모다. 특히 코로나19 치료제·백신 개발과 임상시험에만 3,210억 원이 배정됐다. 10월 말부터 '위드 코로나' 전환을 예정대로 추진하겠다는 정부의 계획에 맞춰 국산 치료제 개발에도 전폭적인 지원을 약속한 셈이다. 여기에 점차 임상을 통과하는 치료제가 줄어들어 예산이 줄어들어도, 경과에 따라 예산 추가 가능성도 열려있는 상황이다. 이에 따라 개발 단계가 앞선 외산 코로나19 치료제에 의존도를 국산 치료제로 빠르게 줄일 수 있다는 기대가 나온다.
1일 식품의약품안전처에 따르면 현재 국내에서 코로나19 치료제로 임상시험계획을 승인받은 제품은 총 22개이고, 이 가운데 14개는 임상시험을 진행 중이며, 8개는 임상 시험이 종료됐다. 올해 2월 조건부 허가 이후 지난 달 정식 품목허가를 받은 셀트리온(068270)의 '렉키로카' 이후 2호 치료제가 아직 나오지 않은 상황이다. 특히 입원하지 않고 코로나19를 치료할 수 있어 위드 코로나의 필수 조건인 '먹는 치료제'는 국내 업체의 개발이 글로벌 제약사에 비해 느리다.
미국 제약사 머크(MSD)는 코로나19 치료제 ‘몰누파라비르’의 임상 3상을 11월까지 마무리하고 연내 긴급 사용 승인을 목표로 하고 있다. 미국 제약사 화이자는 ‘PF-07321332’의 2·3상을, 글로벌 제약사 로슈도 ‘AT-527’의 연내 상용화를 목표로 임상 3상 진행 중에 있다.
반면, 국내에서 부광약품(003000)은 지난 7월 임상 2상을 마친 코로나19 치료제 ‘레보비르’에 대해 통계적으로 유의한 효능을 입증하지 못했다고 지난달 30일 분석 결과를 밝혔다. 그리고 추가적인 개발 계획 없이 코로나19 치료제 개발 중단을 선언했다. 앞서 일양약품(007570)과 GC녹십자(006280)도 사실상 개발을 멈춘 바 있다. 이미 글로벌 제약사에 선수를 뺏긴 상황에서 더이상의 시장 경쟁 진입은 비효율적일 수 있다는 게 일부 제약업계의 분석이기도 하다.
이에 따라 국내 제약사들은 원활하게 임상 피험자 확보를 위해 해외 임상으로 대처하고 있다. 코로나19 감염 위중증 환자가 적은 한국보다 해외 임상과 나아가 현지 상용화를 우선적으로 택하는 것이다.
30일 종근당(185750)은 우크라이나 보건부로부터 자사가 개발하는 코로나19 치료제(CKD-314, 나파벨탄)’의 임상 3상 계획을 승인 받았다. 지난 4월 국내 식약처로부터 승인 받은 나파벨탄의 임상 3상 계획에 따라 국내를 비롯해 8개국에서 진행되는 글로벌 임상으로 이번 승인은 첫 해외 승인이다. 앞서 종근당은 무보증 전환사채로 조달한 1,000억 원 가운데 250억 원을 나파벨탄 연구에 사용한다고 공시할 정도로 적극적이다.
임상 3상 승인을 받은 신풍제약(019170)도 경구용 코로나 치료제 '피라맥스'에 대해 식약처와 글로벌 임상을 협의 중인 것으로 알려졌다. 크리스탈지노믹스(083790)도 국내에서 2상 승인을 받았지만 시험 인원 확보를 위해 미국에서 임상을 진행하기로 했다.
제약업계 한 관계자는 "정부에서도 코로나19 치료를 위한 의료와 사회적 비용을 비교해 국산 코로나 치료제의 중요성을 인지해 지원을 늘려나갈 것으로 기대한다"며 "글로벌 제약사처럼 연내 상용화는 어렵더라도 내년 국내외 상용화를 목표로 치료제 개발에 속도를 높일 것"이라고 말했다.