"셀트리온(068270)의 바이오시밀러 '램시마SC'로 바꿔 처방받은 환자 대다수가 1년째 이탈없이 안정적으로 치료를 받았습니다. 병원에 가지 않고 스스로 투여할 수 있어 염증성장질환(IBD) 환자들의 만족도가 상당히 높습니다."
10일(현지 시간) 오스트리아 메쎄 빈 컨벤션센터에서 열린 유럽장질환학회(UEGW 2022) 세미나에서 필립 스미스(Philip J Smith) 영국 리버풀대학병원 교수(위장병 전문의)는 '인플릭시맙 정맥주사(IV)에서 램시마SC로 교체 처방한 리얼월드 데이터(실제 환자에게 적용해 수집한 데이터)' 발표를 통해 이 같이 밝혔다. 스미스 교수는 "오리지널 레미케이드를 포함한 인플릭시맙 성분 IV 제형에서 램시마SC로 교체 처방한 IBD 환자 181명을 12개월 동안 추적 분석한 결과 투약을 중단하지 않고 지속한 비율이 92.3%에 달했다"며 "사망, 중증 패혈증과 같은 심각한 부작용은 발생하지 않았다"고 전했다.
램시마SC(성분명 인플릭시맙)는 IV 제형의 '램시마'를 피하주사(SC) 제형으로 개량한 제품이다. 램시마는 존슨앤드존슨의 자가면역치료제 ‘레미케이드’의 바이오시밀러로 셀트리온이 개발해 2013년 유럽시장에 진출했다. 셀트리온은 6년만인 2019년 인플립시맙 성분 최초의 SC 제형을 개발해 유럽의약품청(EMA) 판매허가를 받았다. 환자가 약물 투여를 위해 6~8주마다 병원을 방문해야 했던 IV 제형과 달리 2주에 한 번씩 환자 스스로 투여할 수 있어 편의성을 크게 높였다. 특히 오리지널 의약품인 레미케이드에는 없는 SC 제형이어서 완전히 새로운 가치를 창출한 것으로 평가받는다. 이날 공개된 설문 결과에 따르면 램시마SC로 전환한 환자의 77.3%는 IV제형보다 램시마SC를 더 선호한다고 답했다.
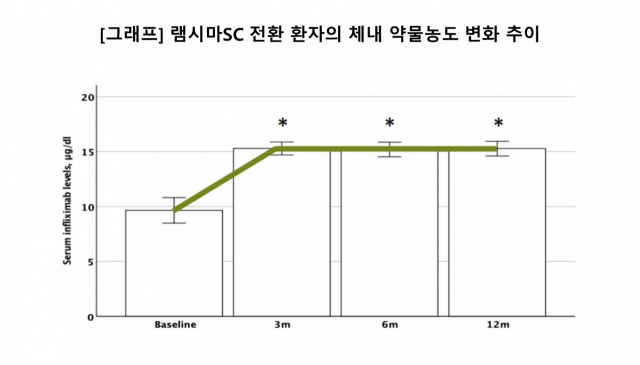
램시마SC는 오리지널 약 보다 한 단계 진화한 일종의 개량신약인 ‘바이오베터’(biobetter)로 평가 받는다. IV 제형을 투여할 때 8.9μg/mL였던 체내 약물농도가 램시마SC를 투약하자 2배 수준인 16.0μg/mL로 올랐기 때문이다. 스미스 교수는 "3, 6, 12개월 시점에 측정한 약물농도가 동일하게 유지됐다"며 "120mg의 단일 용량임에도 IV 제형보다 약물농도 변화가 크지 않아 IBD 증상을 안정적으로 유지할 수 있다"고 평가했다. SC제형이 비정상적인 만성 염증이 호전과 재발을 반복하는 IBD 환자의 장기적 관리에도 유용할 수 있다는 것이다. 미국 식품의약국(FDA 역시 램시마SC 허가심사를 신약에 준해 진행하기로 했다. 셀트리온도 오리지널 의약품과 동등성을 입증하는 대신 위약 대비 효과를 검증하기 위한 3상 임상 시험을 진행 중이다. 이르면 연내 임상을 완료하고 FDA 허가신청이 가능할 것으로 기대된다. 최병서 셀트리온헬스케어(091990) 글로벌마케팅 본부장은 “유럽은 치료 방법을 선택할 때 환자 반응을 주요 지표로 포함하기 때문에 램시마SC의 처방 선호도를 높이는 데 긍정적으로 작용할 것으로 기대된다"며 "실제 의료 현장에서 입증된 램시마SC의 우수성을 세계 각국에 적극적으로 알리겠다"고 강조했다.