삼성바이오에피스가 글로벌 제약사 MSD가 개발한 블록버스터 면역항암제 ‘키트루다(성분명 펨브롤리주맙)’의 바이오 시밀러 개발에 착수한 것으로 확인됐다.
14일 관련 업계에 따르면 삼성바이오에피스는 키트루다 시밀러 개발을 위한 전임상 시험에 돌입할 예정이다. 이를 위해 회사 측은 최근 동물 실험을 위한 임상시험수탁기관(CRO) 업체를 물색한 것으로 전해졌다.
통상 전임상시험이 6개월 간 진행되는 것을 고려하면 연내 임상 1상 진입도 가능할 것으로 보인다. 키트루다의 시장 규모가 수십조 원에 이르는 만큼 임상 3상은 글로벌로 이뤄질 전망이다. 다만 키트루다가 다양한 적응증을 갖는 만큼 어떤 적응증으로 임상을 진행할지는 정해지지 않은 것으로 알려졌다. 업계 한 관계자는 “키트루다가 대표적인 블록버스터 제품인 만큼 시밀러 업계가 특허 만료를 대비한 움직임을 보이고 있다”고 말했다.
키트루다는 면역항암제로 올해 30조 원(238억 달러)의 매출을 올릴 것으로 예상되는 대표적인 블록버스터 의약품이다. 국내에서 허가 받은 적응증만 비소세포폐암 등 10여 종이 넘고 단독 요법 뿐만 아니라 병용 요법으로도 활용된다. 지놈앤컴퍼니(314130)는 담도암을 적응증으로 ‘GEN-001’과 키트루다의 병용 임상 2상을 진행 중이며 이밖에 국내 바이오텍들도 자체 개발한 후보물질과 키트루다의 병용 임상을 추진하고 있는 것으로 알려졌다.
업계에서는 키트루다 등의 특허가 만료되는 2028년을 ‘써드 웨이브(제 3의 파도)’로 보고 있다. 애브비의 ‘휴미라(성분명 아달리무맙)’, 얀센의 ‘스텔라라(우스테키누맙)’ 등의 특허가 풀리는 ‘세컨드 웨이브(제 2의 파도)’ 다음으로 큰 시장이 열릴 것이라는 전망이다. 미국 정부는 의료 비용 절감을 목적으로 바이오 시밀러 시장 지원 정책을 펼치고 있다. 미국 식품의약국(FDA)과 유럽의약품청(EMA) 등 선진국 규제 기관들은 국제의약품규제기관프로그램(IPRP) 같은 포럼을 조직해 바이오시밀러 정보 교류를 추진 중이다. 세계보건기구(WHO)도 바이오시밀러 평가 가이드라인을 주기적으로 업데이트 하고 있다.
키트루다 시밀러는 글로벌 시장에서도 각축전이 예상되는 만큼 개발을 서둘러 시장 경쟁력을 갖추기 위한 포석으로 해석된다. 삼성바이오에피스의 주요 경쟁사는 미국의 암젠, 화이자 등이 꼽힌다.
대표적으로 암젠은 로슈의 표적항암제 ‘허셉틴’, 면역항암제 ‘아바스틴’, 관절염 등 국내에서 15개 적응증을 확보한 애브비의 ‘휴미라’ 바이오 시밀러를 보유하고 있고 미국·유럽에서 모두 점유율 1위를 차지하고 있다. 암젠은 2030년까지 바이오 시밀러로 5조 원 이상의 매출액을 달성하겠다고 밝힌 바 있다. 키트루다가 2028년 44조 원의 매출액을 기록할 것으로 추정되는 만큼 암젠과 경쟁은 피할 수 없다는 게 업계의 시각이다.
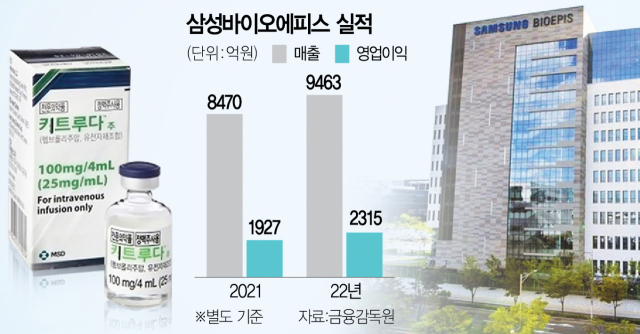
삼성바이오에피스는 현재까지 아바스틴, 휴미라, 루센티스 등 바이오시밀러 6종을 출시해 미국·유럽 등에서 판매하고 있다. 회사 측은 자가면역질환, 항암, 안과 및 희귀질환 등 다양한 바이오시밀러 제품 포트폴리오 확대를 통해 바이오 시밀러 시장에서 경쟁력을 갖춰나갈 계획이다. 삼성바이오에피스의 지난해 매출액(별도기준)은 전년 대비 12% 증가한 9463억 원, 영업이익은 20% 증가한 2315억 원으로 집계됐다.