디지털치료제, 체외진단기기, 인공지능(AI) 진단보조기기, 의료용 로봇 등 신의료기술을 적용한 140가지 품목이 식품의약품안전처 인허가 후 바로 상용화가 가능해진다. 신의료기술평가 등의 절차를 거치기에 앞서 최대 3년간 비급여로 상용화를 허용함으로써 시장 진입 기간이 80~140일로 대폭 줄어들 것으로 전망된다. 다만 안전성 우려와 비급여 확대에 따른 환자 부담 증가 가능성에 따라 부작용이 큰 기술은 퇴출하고 비용 부담이 큰 의료기술은 건강보험 급여 등재를 앞당길 방침이다.
보건복지부와 식약처·국무조정실은 21일 한덕수 국무총리 주재로 열린 국정현안관계장관회의에서 이 같은 내용을 담은 ‘시장 즉시 진입 가능 의료기술’ 제도를 신설하기로 했다고 밝혔다. 관련 법령 개정을 거쳐 내년 하반기 시행이 목표다. 정병규 국무조정실 규제혁신기획관은 “의료기기의 허가부터 병원 사용, 건보 등재에 이르는 절차 전반에 대한 종합 개선안”이라고 말했다.
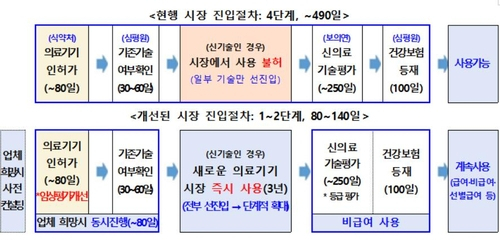
현행 제도에 따르면 새로운 의료기기는 식약처 인허가(최대 80일) 후 건강보험심사평가원이 기존 건강보험에 등재된 기술인지 확인(30~60일)하는 절차를 거친다. 새로운 기술일 경우 의료기기가 사용하는 의료기술의 안전성·유효성을 평가하는 신의료기술평가를 최장 250일간 받아야 한다. 평가를 통과한 뒤에야 건보 등재(100일 소요) 절차를 거쳐 의료 현장에서 건보 급여 혹은 비급여로 사용할 수 있으며 여기까지 490일가량 걸린다.
반면 신의료기기가 개선된 제도를 통하면 식약처 인허가와 심평원의 기존 기술 여부 확인을 거쳐 최장 3년간 비급여로서 사용할 수 있다. 업체가 원하면 인허가와 기존 기술 여부 확인을 동시에 진행할 수 있어 빠르면 80일 이내 상용화가 가능하다. 대신 3년 후 신의료기술평가, 건보 등재를 의무적으로 한다. 또한 식약처 인허가 절차를 국제 기준에 맞춘 임상평가로 강화하고 이를 통과해야 시장 진입이 가능하도록 했다.
이번 개선 방안은 9월 공청회에서 공개돼 의료계·시민단체 등에서 의료기기 안전성, 비급여 양산 등 우려가 제기된 바 있다. 정부는 지속적으로 모니터링해 큰 부작용이 보이는 기술은 사용 중단 조치하기로 했다. 사용 전 환자의 동의를 구하고 환자가 직접 부작용을 신고할 수도 있다. 비급여 사용 현황도 관리해 비용 부담이 큰 의료기술은 3년 경과 전에도 정부 직권으로 건보 급여 등재 절차를 밟게 할 계획이다. 오상윤 복지부 의료자원정책과장은 “비급여 기간과 대상 품목은 매우 한정적”이라며 “제도 개선을 통해 건보 급여를 적극 적용함으로써 비용 부담을 낮추는 것을 고려하고 있다”고 말했다.
한편 정부는 이날 회의에서 중소기업·소상공인 관련 규제 13건을 해소하기로 결정했다. 식품·위생 분야 외국인 근로자의 경우 현장 투입에 앞서 진행해야 하는 법정 건강검진을 외국인등록증 없이 여권만으로 받을 수 있도록 규칙을 개정하기로 했다. 폐배터리를 분쇄해 만드는 블랙파우더(리튬과 니켈 등이 포함된 검은 분말)의 경우 원료 제품으로 인정하고 폐기물 규제에서 제외하는 내용의 폐기물관리법 시행 규칙도 개정한다. 전국 미활용 폐고 367곳을 무상 대부 방식을 활용해 지역 명물로 재탄생시키는 방안도 추진된다.