코로나19에 발목이 잡혔던 우리나라 제약·바이오 업체들이 글로벌 진출 채비를 서두르고 있다. 미국 등 해외 각국이 입국 제한 조치 완화하면서 국산 신약의 영토 확장이 다시 기지개를 켤 것이란 전망이 흘러 나온다. K바이오는 최근 미국 식품의약국(FDA) 현장 실사 지연 등으로 사업에 차질을 빚었다.
13일 업계에 따르면 미 FDA는 코로나19 팬데믹 장기화에 따른 업무 공백으로 어려움을 겪고 있다. 특히 해외 의약품 제조시설 실사 업무는 2020년 3월 정부의 해외 여행 제한 조치 이후 2년 가까이 정상적으로 이뤄지지 못했다.
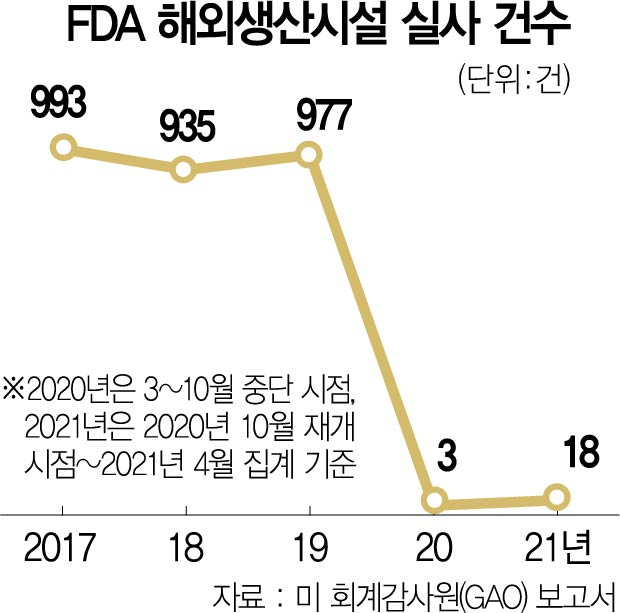
미국 회계감사원(GAO)은 올해 초 보고서를 통해 “지난 2020년 3월부터 10월까지 FDA의 해외실사 진행건수는 3건 뿐이었다”고 지적했다. 지난 2016년~2019년까지 FDA가 연평균 985건의 해외실사를 진행한 것과 비교하면 크게 대비되는 수치다. 2020년 10월부터 조심스럽게 업무를 재개했지만 이듬해 4월까지 중국 실사만 18번 진행하는 데 그쳤다.
FDA는 의약품 승인전 단계 실사에 대해 해외 규제기관의 실사정보를 공유하거나 의약품 샘플링, 원격회의 등 비대면 방식으로 대체하고 있는데, 완벽한 대안이 되진 못하고 있다. 실제 GC녹십자(006280)는 지난달 28일 FDA로부터 일차성 면역결핍질환 치료제 ‘알리글로’의 허가심사 연기를 통보받았다. GC녹십자는 지난해 11월 코로나19 상황으로 오창 혈액제제 생산시설에 대한 FDA 현장실사를 ‘비대면 평가’로 대체했는데, FDA는 “추가 현장실사가 필요하다”는 입장을 전했다. GC녹십자는 조속하게 현장실사를 추진한다는 방침이다.
앞서 한미약품(128940)은 호중구감소증 치료제 ‘롤론티스’의 FDA 바이오의약품허가신청(BLA) 이후 원액 제조를 담당하는 평택 바이오플랜트의 현장실사를 진행하기까지 무려 1년 8개월이 걸렸다. 한미약품의 해외 파트너 스펙트럼은 보완사항을 개선하고 빠르면 상반기 중 롤론티스 BLA을 다시 할 예정이다.
업계는 최근 미국 등 해외 각국이 코로나19 방역 조치를 대부분 해제하며 일상복귀를 추진하자 FDA 현장실사가 재개될 것이란 기대를 키우고 있다. 미국은 한때 하루 80만 명을 넘겼던 확진자수가 2만~3만 명대로 떨어지자 50개주 전체가 실내 마스크 착용 의무화 해제 계획을 발표했다. 다음달 8일 미국 뉴올리언스에서 열리는 미국암연구학회(AACR)는 3년 만에 현장 개최를 앞두고 있다. 유한양행(000100)·브릿지바이오테라퓨틱스 등 국내 기업 10여 곳도 참석할 신약 연구 성과를 소개할 예정이다.
연내 FDA 허가를 점쳐온 국산 신약들의 행보에도 힘이 실릴 것으로 기대된다. 한미약품이 스펙트럼에 기술이전한 폐암 신약후보물질 ‘포지오티닙’은 지난달 FDA로부터 11월 24일을 심사기한으로 부여받았다. 지난해 3월 신약허가신청(NDA)을 완료한 메지온(140410)의 폰탄 치료제 ‘유데나필’도 연내 FDA 허가를 기대하고 있다. 유한양행으로부터 폐암 치료제 ‘렉라자’의 글로벌 판권을 도입한 얀센은 3상 임상시험이 막바지 단계에 이르면서 연내 NDA를 계획 중이다.