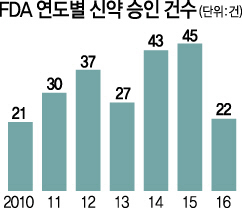
지난해 미국 식품의약품(FDA)의 승인을 받은 혁신 신약 건수가 지난 2010년 이후 6년 만에 최저치를 기록하며 제약사들의 연구개발(R&D) 생산성 저하에 대한 우려가 깊어지고 있다.
3일(현지시간) 로이터 등 외신에 따르면 지난해 FDA 관문을 통과한 혁신 신약은 총 22건으로 2015년 45건의 절반 수준에 그쳤다. 절차가 비교적 간단한 희귀질환 치료약물의 개발이 늘어나면서 FDA의 신약 승인 건수는 2011~2015년 연평균 37개를 기록하며 점진적 증가 추세를 보여왔다.
지난해 신약 승인 건수가 감소한 것은 우선 일종의 기저효과 때문이다. 5개 신약이 예상보다 이른 2015년 말 허가를 받은 반면 몇몇 약품이 당초 전망과 달리 지난해 승인을 받지 못하고 다소 늦어지고 있다는 것이다. 릴리사의 알츠하이머 치료제 ‘솔라네주맙’과 같이 개발이 실패로 귀결되거나 FDA로부터 승인을 거부당한 신약도 적지 않았다.
나아가 신약개발 장벽이 높아진 것이 근본적인 이유로 꼽힌다. 치료해야 하는 질환의 수준은 점차 복잡해지고 신약 후보 물질은 찾기 힘들어지는 가운데 FDA 등 허가 기관은 점차 더 많은 데이터를 요구하고 있다는 것이다. 이 때문에 R&D 비용은 계속 늘지만 승인되는 신약의 개수는 연간 20여건 수준에 머무는 등 앞으로도 생산성 저하 현상이 지속될 것으로 보인다. 최근 딜로이트사의 자료에 따르면 상위 12개 제약회사의 R&D 투자 수익률은 2010년 10.1%에서 2016년 3.7%로 떨어졌다.
지금까지 대형 다국적 제약사들은 혁신 신약의 약값을 높게 책정해 이 문제를 해결하고자 했지만 최근 ‘약가 인하’에 대한 각국의 압력이 높아지며 이마저도 쉽지 않을 것으로 전망된다.