‘먹는 인슐린’은 의약업계에 숙원이다. 상용화에 이를 경우 당뇨병 환자들의 편익이 획기적으로 개선될 수 있다. 하지만 상용화까지는 여전히 갈길이 멀다는 게 전문가들의 분석이다.
췌장 베타세포에서 분비되는 인슐린은 간에서 포도당의 합성을 억제, 혈당이 일정한 범위에서 유지되게 한다. 이를 보완·대체하는 인슐린 제제는 현재 피하주사형 제품만 상용화돼 있다. 먹는 인슐린은 위에서 분비되는 위산, 소장의 분해효소를 이겨내고 소장 벽을 뚫고 들어가야 하기 때문이다. 세 관문을 통과하더라도 피하주사형 인슐린 제제 수준의 가격경쟁력을 갖춰야 상업성을 가질 수 있다.
덴마크계 글로벌 제약회사 노보노디스크가 흡수강화제(나트륨 캡레이트)가 들어간 먹는 인슐린 제제 2상 임상시험에 성공했지만 최근 개발을 중단했다. 투자 대비 상업성이 떨어진다는 판단에서다. 먹는 인슐린의 혈당강하율은 2.6mmol/ℓ로 피하주사용 인슐린(2.3mmol/ℓ)과 거의 동등했다.
김대중 아주대병원 내분비내과 교수(대한당뇨병학회 홍보이사)는 “먹는 인슐린은 소화 과정을 거치면 생체이용률이 떨어지고 피하주사 인슐린보다 많은 용량을 필요로 한다”며 “체내에서 인슐린 농도를 안정적으로 유지하기 어렵다는 점도 해결해야 할 과제”이라고 말했다.
미국 하버드대 공학·응용과학대학(SEAS)의 사미르 미트라고트리 생명공학 교수팀도 지난해 3대 난제를 해결한 인슐린 캡슐을 개발했지만 임상시험과 가격경쟁력이란 험난한 관문을 통과할 수 있을 지 불투명하다.
미트라고트리 교수팀이 개발한 먹는 인슐린은 필수 영양소인 콜린과 식품첨가제로 쓰이는 게란산으로 된 이온성 액체에 인슐린을 분산시킨 뒤 폴리머 코팅 캡슐에 담았다. 그래서 위산과 소장에서 분비되는 소화효소에 분해되지 않으며 소장 점막과 단단한 소장 벽을 쉽게 뚫고 들어간다. 쥐 실험에서 투여 후 첫 2시간 사이에 혈당이 투여 전 수치의 62%, 10시간 후에는 55%까지 떨어지는 효과도 확인됐다.
먹는 인슐린의 가장 큰 장점은 체내에서 자연적으로 만들어지는 인슐린처럼 소화관에서 간(肝)으로 직행한다는 점이다. 피하주사형 인슐린은 혈관을 통해 온몸을 돌고 돌아 간으로 들어간다.
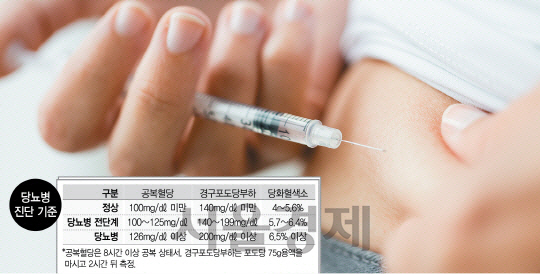
먹는 인슐린이 필요한 당뇨병 환자는 인슐린이 분비되지 않는 1형 당뇨병 환자보다는 조금만 분비되거나 인슐린 저항성이 커진 2형 당뇨병 환자다. 김 교수는 “2형 당뇨병 환자의 10~20%는 공복혈당이 300㎎/㎗(정상 100㎎/㎗ 미만)를 웃도는 급성 고혈당이 오는 데 이런 경우 초기에 인슐린 치료를 하면 혈당이 확 좋아진다”며 “당뇨병을 15~20년 이상 앓은 환자 가운데 먹는 당뇨병 약을 몇 가지 함께 복용해도 효과가 없으면 인슐린 치료가 필요해진다”고 설명했다.
당뇨병은 인슐린·글루카곤 분비, 간에서의 새로운 포도당 생산, 근육 등 말초 조직에서의 포도당 사용 조절에 문제가 생겨 발병한다. 췌장에서 인슐린이 분비되지 않거나(제1형 당뇨병), 분비량이 적거나 정상적으로 기능하지 않아(제2형 당뇨병) 혈당이 만성적으로 높아진다. 밥·빵·라면·설탕 등 탄수화물이나 당류를 먹으면 소화 과정을 거쳐 포도당으로 분해된다. 포도당은 혈액을 타고 뇌·근육 등 인체 조직의 에너지원으로 사용된다.