존 마스콜라 국립보건원(NIH) 백신연구센터 소장은 5일 뉴욕타임스와의 인터뷰에서 “(4주 간격으로 진행되는 모더나 백신 1차·2차 투여량을) ‘표준용량’의 반으로 줄일 경우의 면역반응 수준을 확인하기 위해 NIH와 모더나 연구진이 임상시험 참여자 자료를 되짚어보고 새로운 임상시험을 할지 검토 중”이라며 “결과가 좋으면 자료를 취합해 FDA와 (투여량 변경을) 논의할 것”이라고 밝혔다.
코로나19가 위세가 갈수록 심해지고 백신 수급 문제 등으로 인해 신속한 예방접종이 이뤄지지 않자 같은 양으로 접종자를 2배 늘리는 방안을 모색하고 있는 것이다.
앞서 미 행정부의 코로나19 백신 개발 프로그램 ‘초고속작전’ 최고책임자인 몬세프 슬라위는 방송에 출연해 FDA가 모더나와 이 같은 논의를 하고 있다고 말했다. 슬라위는 초고속작전 최고책임자를 맡기 직전 모더나 이사회 멤버 등으로 활동한 백신 전문가다.
슬라위는 “18~55세 성인을 대상으로 한 (2상) 임상시험에서 모더나 백신을 50㎍(0.05㎎)씩 2회 맞은 사람과 ‘표준용량’인 100㎍(0.1㎎)을 2회 맞은 사람이 비슷한 중화항체(바이러스의 스파이크 단백질에 달라붙어 사람 세포에 침투하지 못하게 하는 항체) 반응을 보였다”며 “모더나 백신 접종량을 반으로 줄이는 방안을 연구 중”이라고 설명했다.
미 질병통제예방센터(CDC)에 따르면 5일 오전 9시까지 미국에서 화이자와 모더나의 코로나19 mRNA 백신 1,702만여회 접종분이 배포됐지만 28%(약 484만회 접종분)만 접종된 것으로 집계됐다. 감염 및 사망 위험이 높은 장기요양시설의 경우 326만여회 접종분 중 13%(약 43만회)만 접종됐다.
유럽연합(EU)과 회원국, EU를 탈퇴한 영국은 1차·2차 접종간격을 가능한 범위 안에서 최대한 늘려잡아 1차 접종자 확대에 나서고 있다. ‘얕은 면역력’이라도 갖는 1차 접종자를 늘려 신규 확진자 수를 줄이고 의료시스템 붕괴를 막아보려는 고육책이다.
유럽의약품청(EMA)은 화이자 백신의 접종간격에 대해 임상시험에서 2차 접종이 1차 접종 19∼42일 뒤 이뤄졌다는 것을 근거로 6주까지는 긴급사용승인 범위에서 벗어나지 않는다는 입장을 밝혔다. 화이자가 권고하는 3주 간격의 2배다.
EMA는 다만 6주를 넘기려면 추가 임상시험과 승인사항 변경이 필요하며, 이런 절차를 거치지 않고 6주를 넘긴 2차 접종은 ‘허가 외(오프라벨) 사용’으로 간주돼 화이자가 효능에 대한 책임을 덜 지게 된다고 해석했다.
이에 따라 옌스 슈판 독일 보건부 장관은 화이자 백신의 1차·2차 접종간격을 6주로 늘리는 방안을 연구하라고 질병관리당국(로베르트코흐연구소)에 지시했다. 덴마크의 소렌 브로스트롬 보건부 장관도 “화이자 백신의 접종간격을 최대 6주까지 늘리기로 했다. 예방 효능을 확신할 수 있는 과학적 증거를 보지 못해 6주 초과는 권고할 수 없다. 3∼4주 간격 접종이 가능해지면 언제라도 원래 지침을 따르겠다”고 밝혔다.
영국 정부는 4일부터 접종을 시작한 아스트라제네카 백신에 대해 1차·2차 접종간격을 12주로 할 것을 권고했다.
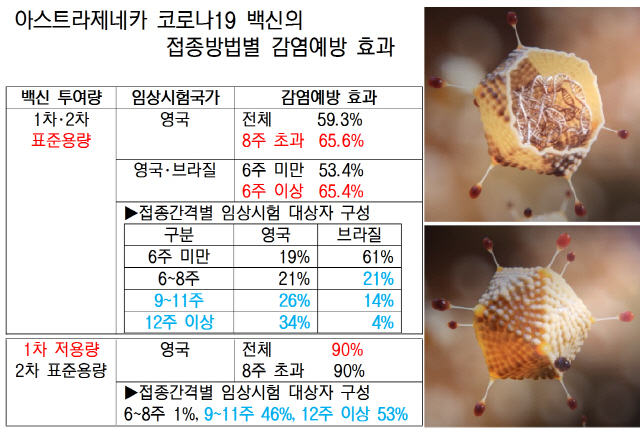
지난달 의학 저널 ‘랜싯’에 발표된 이 백신의 임상시험 중간결과 논문에 따르면 아스트라제네카는 영국·브라질에서 실시한 임상시험에 필요한 백신을 당초 계획했던 접종간격 4주에 맞춰 공급하지 못하자 임상시험 중 1차·2차 투여간격과 투여량을 수정했다. 이 때문에 영국 내 임상시험에서 90%의 감염예방 효과를 보인 ‘1차 저용량(표준용량의 2분의1)+2차 표준용량 투여군’의 접종간격은 53%가 12주 이상, 99%가 9주 이상이었다. 영국에서 2회 모두 표준용량 투여군의 감염예방 효능은 접종간격 9주 이상(10명 중 6명)이 65.6%로 전체 평균인 59.3%를 웃돌았다. 영국·브라질을 합친 표준용량 투여군 평가에서도 접종간격 6주 이상의 감염예방 효능이 65.4%로 6주 미만(53.4%)보다 높았다. 다만 논문에는 최적의 접종간격이 6주인지, 9~11주인지, 12주인지를 판단할 명확한 근거가 부족하다.