제약·바이오 업계가 바이오헬스혁신위원회(혁신위)에 기대하는 요구사항 중 하나는 전폭적인 규제완화다. 기술력 있는 업체들의 시장 선점을 위해서는 혁신 의료기기와 의약품에 대한 발 빠른 인허가가 필요하지만 겹겹이 쌓인 규제가 발목을 잡아 타이밍을 놓치는 기업들이 상당수이기 때문이다.
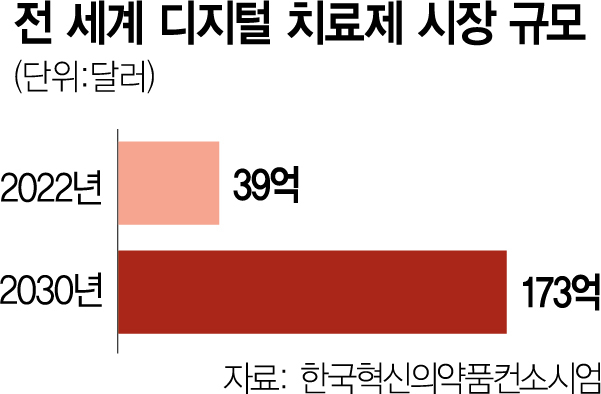
5일 업계에 따르면 디지털 치료제(DTx)와 소비자직접의뢰(DTC) 유전자 검사 등 바이오 업계에서 새로운 먹거리로 부상하고 있지만 정부 규제가 걸림돌이 되고 있다는 지적이 많다. 디지털 치료제는 치매 등 신경 퇴행성 질환 치료와 재활·물리치료 등에 쓰이는 치료제다. 체내에 직접 약물을 투여하지 않고 애플리케이션, 게임, 가상현실 등을 활용해 질병과 후유증을 치료한다. 현재 임상을 거쳐 정부의 허가까지 받은 국산 디지털 치료제로는 에임메드의 ‘솜즈(Somzz)’와 웰트의 ‘웰트아이(WELT-I)’ 등이 있다.
가장 큰 문제는 디지털 치료제의 특수성을 고려하지 않은 규제 환경 탓에 허가 자체를 받기가 쉽지 않다는 점이다. 모바일 애플리케이션 기반 디지털 치료제를 개발 중인 스타트업 관계자는 “임상에서 일반 약물 임상과 같은 수준의 검증을 거쳐야 하는데 소프트웨어에 제약사와 같은 잣대를 적용하는 것이 적절한지 의문”이라고 지적했다. 신재용 연세대 의대 예방의학교실 교수(에버트라이 대표)는 “디지털 치료제 분야에서 구체적이고 체계적인 임상시험 프로토콜 제작이 필요하다”고 말했다.
허가를 받은 뒤에는 수가 문제가 발목을 잡는다. 솜즈와 웰트아이는 9월부터 3년간 임시로 건강보험을 적용받게 됐지만 이후 의료기술 평가 등을 거쳐 정식 등재 절차를 밟아야 한다. 하지만 각종 중복 심사를 거쳐야 하고 진료기관·과목 제한까지 있다 보니 데이터를 모으기가 어렵고 정식 수가를 받기까지 장기간이 소요된다. 반면 독일에서는 디지털 치료제 허가를 받으면 바로 현장에서 1년간 데이터를 축적하고 정식 수가를 받을 수 있다.
DTC 유전자 검사도 규제에 발이 묶인 신산업이다. DTC 유전자 검사는 소비자가 의료기관을 거치지 않고 타액 등을 검사기관에 전달하면 자신의 유전자 정보를 알 수 있는 서비스다. 우리나라에서는 현재 탈모, 피부노화 등 웰니스(웰빙·행복·건강) 101개 항목만 검사할 수 있고 당뇨·암·치매 등 질병에 대한 DTC 검사는 금지된다. 미국·일본 등 해외에서 네거티브 방식으로 극히 일부 항목을 제외하고 300~400여개 항목을 허용해주는 것과 대조적이다.