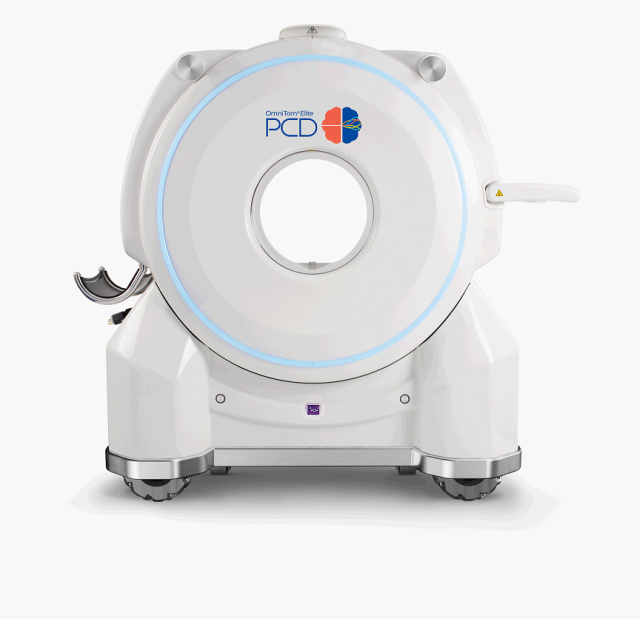
삼성전자의 미국 의료기기 자회사 ‘뉴로로지카’가 미국 식품의약국(FDA)에서 이동형 컴퓨터단층촬영(CT) ‘옴니톰 엘리트 PCD’의 신규 기능을 추가 승인 받았다. 해상도와 스캔 범위 등 주요 기능이 대폭 업그레이드됐다.
뉴로로지카는 이달 10일(현지 시간) FDA에서 옴니톰 엘리트 PCD의 신규 기능에 대해 추가 승인을 받았다고 22일 밝혔다. 승인된 버전에는 더욱 품질 높은 이미지 구현이 가능한 초고해상도 모드가 추가됐다. 조영제를 투여해 찍은 CT영상에서 잔여 조영제가 보이지 않도록 영상을 조정할 수 있다. 이밖에도 PCD 특화 애플리케이션, 스캐닝 범위 확장, 연속 나선형 스캔 기능 등이 추가됐다.
옴니톰 엘리트 PCD는 광자계수검출기(PCD)를 탑재한 이동형 CT로 2022년 세계 최초로 FDA 승인을 받았다. 반도체를 활용한 차세대 CT 스캐닝 기술로 섬광체 방식 보다 월등히 높은 해상도와 낮은 노이즈의 CT 영상을 제공하는 것이 특징이다. 촬영 중 주변에 방출되는 방사선량도 의미 있는 수준으로 줄여 전문 촬영실이 아닌 중환자실이나 수술실에서 사용 가능하다. 미국 내 4350개 이상 병원을 회원사로 보유한 병원 관리 및 구매 대행기업 프리미어가 선정한 ‘올해의 혁신 기술’에 선정되기도 했다.
삼성전자는 이번 FDA 추가 승인으로 모바일 CT 분야에서 더욱 높은 글로벌 시장 경쟁력을 갖출 것으로 기대했다. 유규태 삼성전자 의료기기사업부장 겸 삼성메디슨 대표는 “진단 편의를 높이기 위한 신규 기능 개발로 FDA 추가 승인을 받게 되어 기쁘다” 며 “앞으로도 메디컬 이미징 분야에서 신기술 개발에 앞장서며 의료진 편의와 함께 진단 정확도까지 높일 수 있도록 노력하겠다”고 말했다.
한편 옴니톰 엘리트 PCD는 유럽연합 의료기기 규제(CE MDR) 인증을 앞두고 있다. 유럽 의료기기 시장규모는 2020년 기준 약 62조원으로 북미 다음으로 큰 의료기기 수요처다. 국내에서는 기존 FDA 승인에 기반한 기능에 대해 지난해 식약처 허가를 취득했다. 삼성메디슨이 옴니톰 엘리트 PCD를 비롯한 뉴로로지카의 이동형 CT제품과 삼성전자의 디지털 엑스레이의 국내 판매와 서비스를 담당하고 있다.